Липопротеинлипаза
| Липопротеинлипаза | |
|---|---|
| Обозначения | |
| Символы | LPL; LIPD |
| Entrez Gene | 4023 |
| HGNC | 6677 |
| OMIM | 238600 |
| RefSeq | NM_000237 |
| UniProt | P06858 |
| Другие данные | |
| Шифр КФ | 3.1.1.34 |
| Локус | 8-я хр., 8p22 |
Липопротеинлипаза (ЛПЛ, КФ 3.1.1.34) — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ХМ и ЛПОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.
Синтез липопротеинлипазы
ЛПЛ синтезируется в большинстве тканей организма кроме печени, где синтезируется специфическая печёночная липаза. Наиболее богаты липопротеинлипазой сердце, скелетные мышцы и жировая ткань.
После трансляции белок гликозилируется в эндоплазматическом ретикулуме. ЛПЛ человека гликозилируется по аминокислотным остаткам Асп-43, −257 и −359[1][2][3][4]. После этого глюкозидазы удаляют остатки глюкозы. В аппарате Гольджи олигогахаридная часть ЛПЛ трансформируется либо в две сложные цепи, либо в одну полиманнозную цепь[1][2]. В зрелом белке ЛПЛ углеводная часть составляет 12 % от общей молекулярной массы, составляющей 55-58 кДа[1][2][5].
Гомодимеризация ЛПЛ требуется для секреции фермента из клетки[5][6]. ЛПЛ секретируется клетками в виде гликозилированного гомодимера, после чего фермент транслоцируется во внеклеточный матрикс, проходит через слой эндотелиальных клеток кровеносного сосуда и выходит в просвет капилляров. В просвете капилляров ЛПЛ гликозилфосфатидилинозитол-заякоренному белку GPIHBP1[7][8].
Структура
Кристаллическая структура была разрешена для комплекса ЛПЛ/GPIHBP1[9][10]. ЛПЛ состоит из двух отдельных доменов: более крупный N-терминальный домен, который включает липолитический активный сайт, и меньший C-терминальный домен. N-терминальный домен имеет глобулярную α/β-гидролазную структуру, включающую центральный бета-лист, окружённый альфа-спиралями. C-терминальный домен представляет собой удлинённый цилиндрический бета-сэндвич из двух бета-листов.
Механизм
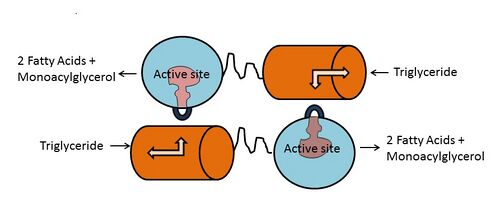
Активный центр ЛПЛ состоит из триады Сер-132, Асп-156 и Гис-241. Другие каталитически-важные регионы N-терминального домена включают т. н. оксианионную дыру (аминокислотные остатки Три-55 и Лей133), покрывающий фрагмент (остатки 216—239) и петля бета-5 (остатки 54-64)[1][11][4]. Локализация участка связывания аполипопротеина апоС-II неизвестна, но взаимодействие ЛПЛ с ним требует обоих N- и C-теминальных доменов. C-теминальный домен определяет субстратную специфичность фермента, он обладает более высокой аффинностью к крупным триглицерид-богатм липопротеинам, чем к более мелким холестерин-обогащённым липопротеинам[12]. C-терминальный домен также участвует в связывании с рецепторами ЛПНП[13]. Оба N- и C-теминальные домены содержат гепарин-связывающие участки, удалённые от липид-связывающих участков, и, таким образом, молекула ЛПЛ может служить связывающим звеном между клеточной поверхностью и липопротеинами. Следует также отметить, что связывание ЛПЛ с поверхностью клетки и клеточными рецепторами не зависит от её ферментативной активности[14].
Мономеры ЛПЛ в димерном состоянии фермента находятся в перевёрнутом по отношению друг к другу положении. Триада серин-аспарагин-гистидин расположена в гидрофобном углублении, которое закрыто от внешней среды покрывающим фрагментом[1][11]. При связывании апоС-II и липопротеинового липида с C-доменом представляет молекулу липида покрывающему фрагменту и гидрофобному углублению, что приводит к транслокации покрывающего фрагмента и открытию активного центра фермента. β5-петля уходит в центр белка и приближает электрофил оксианионной дыры в положение для липолиза[1]. При этом глицеридная часть молекулы триглицерида входит в активный центр и эфирная связь гидролизуется.
Две молекулы апоС-II могут связаться с димером ЛПЛ[15]. Оценено, что одновременно с одной частицей липопротеина может быть связано до 40 молекул ЛПЛ[1]. Считается, что лимитирующим звеном катализа является высвобождение продукта реакции в среду[11].
Функции
Ген LPL кодирует фермент липопротеинлипазу, которая экспресирована в сердце, скелетных мышцах и жировой ткани[16][17]. ЛПЛ существует как гомодимер и несёт двойную функцию: она действует как фермент, гидролизуя триглицериды и служит лиганд-связывающим мостиком при рецептор-опосредованной интернализации липопротеинов. Каталитическая активность ЛПЛ превращает ЛПОНП сначала в ЛППП, а затем в ЛПНП. Мутации, вызывающие тяжёлую недостаточность ЛПЛ, приводит к гиперлипопротеинемии I типа, а мутации, частично снижающие её ферментативную активность. вызывают различные нарушения липидного метаболизма[18].
Регуляция
ЛПЛ контролируется как транскрипционно, так и посттранскрипционно[19]. Циркадный ритм может служить важным фактором в регуляции контроля за уровнем мРНК липопротеинлипазы в периферических тканях[20].
Изоферменты ЛПЛ регулируются различным образом в зависимости от ткани. Так, известно, что инсулин активирует ЛПЛ в адипоцитах и локализацию фермента на поверхности эндотелия капилляров и, наоборот, снижает экспрессию ЛПЛ в мышцах[21]. ЛПЛ в скелетных мышцах и в миокарде активируется глюкагоном и адреналином. Такая регуляция объясняет, почему натощак активность ЛПЛ повышена в мышечной ткани и понижена в жировой, тогда как после приёма пищи наблюдается обратная картина[1][2].
В соответствии с описанной регуляцией различные диеты различным образом влияют на активность ЛПЛ в жировой и мышечной тканях. Показано, что после 16 дней высокоуглеводной или высокожировой диеты активность ЛПЛ значительно повышалась в обеих тканях через 6 часов после приёма пищи, но повышение было сильнее в жировой ткани в ответ на высокоуглеводную диету. При этом указанные диеты не влияли на чуствительность к инсулину и на уровень ЛПЛ натощак в обеих тканях[22].
Уровень ЛПЛ, локализованной на поверхности эндотелиальных клеток не регулируется этими клетками, так как они не синтезируют и не расщепляют фермент. Регуляция фермента осуществляется за счёт притока вновь синтезированной ЛПЛ и регуляции активности фермента, находящегося на поверхности эндотелия. Ключевым белком в этой регуляции является ANGPTL4, играющий роль локального ингибитора ЛПЛ. Индукция ANGPTL4 отвечает за ингибирование активности ЛПЛ в белой жировой ткани в состоянии натощак. Кроме этого, ANGPTL4 также участвует в физиологической регуляции ЛПЛ в ряде других тканей[23]
Для объяснения изменения активности ЛПЛ в ходе циклов (приём пищи) — (состояние натощак) была предложена модель ANGPTL3-ANGPTL4-ANGPTL8[24]. Приём пищи индуцирует ANGPTL8, активируя сигнальный путь ANGPTL8-ANGPTL3, который ингибирует ЛПЛ в сердечной и скелетных мышцах, что обеспечивает высокий уровень триглицеридов в крови и их доступность для жировой ткани, в которой активность ЛПЛ повышается благодаря понижению в жировой ткани уровня ингибирующего ANGPTL4. Обратная ситуация возникает натощак, когда ANGPTL8 в мышцах подавляется, а ANGPTL4 в жировой ткани, наоборот, индуцируется, что приводит к притоку триглицеридов к мышечной ткани[24].
Клиническое значение
Недостаточность липопротеинлипазы приводит к гипертриглицеридемии (то есть повышенному содержанию триглицеридов в крови)[25]. Было также показано, что у мышей избыточная экспрессия ЛПЛ может приводить к инсулинорезистентности[26][27] и стимулировать ожирение[20].
Экспрессия ЛПЛ является прогностическим признаком хронического лимфолейкоза[28]. При этом заболевании ЛПЛ, видимо, участвует в обеспечении злокачественных клеток жирными кислотами как источника энергии[29]. Таким образом, повышенный уровень липопротеинлипазы (мРНК или белка) считается индикатором неблагоприятного исхода[30][31][32][33][34][35][36][37][38][39].
Взаимодействия
ЛПЛ взаимодействует с рецептором LRP1[40][41][42]. Этот фермент также является лигандом для белков α2M, GP330 и рецепторов ЛПОНП[13]. Кроме этого, ЛПЛ является лигандом для рецептора LRP2, хотя и с меньшей аффинностью, чем для других рецепторов. Тем не менее, именно взаимодействие ЛПЛ с LRP2 отвечает за основную долю деградации ЛПОНП под действием ЛПЛ[13]. Во всех случаях ЛПЛ играет роль мостика между соответствующим рецептором и липопротеином. ЛПЛ активируется аполипопротеином C2 и ингибируется аполипопротеином C2[11].
В других организмах
Известно, что ген LPL — высококонсервативный ген среди позвоночных. ЛПЛ, например, участвует в липидном транспорте в плаценте у живородящих ящериц Pseudemoia entrecasteauxii[43].
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 (December 2002) «Lipoprotein lipase: structure, function, regulation, and role in disease». J. Mol. Med. 80 (12): 753–69. doi:10.1007/s00109-002-0384-9. PMID 12483461.
- ↑ 2,0 2,1 2,2 2,3 (October 1992) «Regulation of the synthesis, processing and translocation of lipoprotein lipase». The Biochemical Journal 287 ( Pt 2) (2): 337–47. doi:10.1042/bj2870337. PMID 1445192.
- ↑ (March 1989) «The relation between glycosylation and activity of guinea pig lipoprotein lipase». J. Biol. Chem. 264 (7): 4195–200. doi:10.1016/S0021-9258(19)84982-7. PMID 2521859.
- ↑ 4,0 4,1 (April 1994) «Lipoprotein lipase domain function». J. Biol. Chem. 269 (14): 10319–23. doi:10.1016/S0021-9258(17)34063-2. PMID 8144612.
- ↑ 5,0 5,1 (August 1989) «Biosynthesis of lipoprotein lipase in cultured mouse adipocytes. II. Processing, subunit assembly, and intracellular transport». J. Biol. Chem. 264 (22): 13206–16. doi:10.1016/S0021-9258(18)51616-1. PMID 2753912.
- ↑ (February 1989) «The role of glucose and glycosylation in the regulation of lipoprotein lipase synthesis and secretion in rat adipocytes». J. Biol. Chem. 264 (6): 3177–82. doi:10.1016/S0021-9258(18)94047-0. PMID 2644281.
- ↑ (2007) «Glycosylphosphatidylinositol-anchored high-density lipoprotein-binding protein 1 plays a critical role in the lipolytic processing of chylomicrons.». Cell Metabolism 5 (4): 279–291. doi:10.1016/j.cmet.2007.02.002. PMID 17403372.
- ↑ (July 2010) «GPIHBP1 is responsible for the entry of lipoprotein lipase into capillaries». Cell Metabolism 12 (1): 42–52. doi:10.1016/j.cmet.2010.04.016. PMID 20620994.
- ↑ PDB 6E7K; (January 2019) «Structure of the lipoprotein lipase-GPIHBP1 complex that mediates plasma triglyceride hydrolysis». Proceedings of the National Academy of Sciences of the United States of America 116 (5): 1723–1732. doi:10.1073/pnas.1817984116. PMID 30559189.
- ↑ PDB 6OAU; (May 2019) «Structure of lipoprotein lipase in complex with GPIHBP1». Proceedings of the National Academy of Sciences of the United States of America 116 (21): 10360–10365. doi:10.1073/pnas.1820171116. PMID 31072929.
- ↑ 11,0 11,1 11,2 11,3 (January 1992) «Structure and functional properties of lipoprotein lipase». Biochimica et Biophysica Acta 1123 (1): 1–17. doi:10.1016/0005-2728(92)90119-M. PMID 1730040.
- ↑ (April 2000) «Contribution of the carboxy-terminal domain of lipoprotein lipase to interaction with heparin and lipoproteins». Biochem. Biophys. Res. Commun. 271 (1): 15–21. doi:10.1006/bbrc.2000.2530. PMID 10777674.
- ↑ 13,0 13,1 13,2 (July 1996) «Lipoprotein lipase binds to low density lipoprotein receptors and induces receptor-mediated catabolism of very low density lipoproteins in vitro». J. Biol. Chem. 271 (29): 17073–80. doi:10.1074/jbc.271.29.17073. PMID 8663292.
- ↑ (October 1991) «Lipoprotein lipase enhances the binding of chylomicrons to low density lipoprotein receptor-related protein». Proc. Natl. Acad. Sci. U.S.A. 88 (19): 8342–6. doi:10.1073/pnas.88.19.8342. PMID 1656440. .
- ↑ (June 2003) «Identification of a lipoprotein lipase cofactor-binding site by chemical cross-linking and transfer of apolipoprotein C-II-responsive lipolysis from lipoprotein lipase to hepatic lipase». J. Biol. Chem. 278 (25): 23027–35. doi:10.1074/jbc.M300315200. PMID 12682050.
- ↑ Protein Atlas, Protein Atlas Tissue expression of LPL - Summary - The Human Protein Atlas. www.proteinatlas.org. The Human Protein Atlas. Дата обращения: 25 июля 2019. Архивировано 25 июля 2019 года.
- ↑ Gene Cards, Gene Cards Human Gene Database. www.genecards.org. GeneCardsSuite. Дата обращения: 25 июля 2019. Архивировано 8 июня 2019 года.
- ↑ Entrez Gene: LPL lipoprotein lipase. Дата обращения: 12 декабря 2021. Архивировано 17 октября 2009 года.
- ↑ (2009) «Lipoprotein lipase: from gene to obesity.». Am J Physiol Endocrinol Metab 297 (2): E271–88. doi:10.1152/ajpendo.90920.2008. PMID 19318514.
- ↑ 20,0 20,1 (2012) «The nuclear receptor REV-ERBα is required for the daily balance of carbohydrate and lipid metabolism.». FASEB J 26 (8): 3321–35. doi:10.1096/fj.12-208751. PMID 22562834.
- ↑ (October 1989) «Effects of insulin and exercise on muscle lipoprotein lipase activity in man and its relation to insulin action». J. Clin. Invest. 84 (4): 1124–9. doi:10.1172/JCI114275. PMID 2677048.
- ↑ (August 1998) «Effect of dietary macronutrient composition on tissue-specific lipoprotein lipase activity and insulin action in normal-weight subjects». Am. J. Clin. Nutr. 68 (2): 296–302. doi:10.1093/ajcn/68.2.296. PMID 9701186.
- ↑ (2014) «Regulation of lipoprotein lipase by Angptl4.». Trends Endocrinol. Metab. 25 (3): 146–155. doi:10.1016/j.tem.2013.12.005. PMID 24397894.
- ↑ 24,0 24,1 (April 2016) «The ANGPTL3-4-8 model, a molecular mechanism for triglyceride trafficking.». Open Biol. 6 (4): 150272. doi:10.1098/rsob.150272. PMID 27053679.
- ↑ (November 2007) «A novel complex deletion-insertion mutation mediated by Alu repetitive elements leads to lipoprotein lipase deficiency». Mol. Genet. Metab. 92 (3): 229–33. doi:10.1016/j.ymgme.2007.06.018. PMID 17706445.
- ↑ (2001) «Overexpressing human lipoprotein lipase in mouse skeletal muscle is associated with insulin resistance.». Diabetes 50 (5): 1064–8. doi:10.2337/diabetes.50.5.1064. PMID 11334409.
- ↑ (2001) «Tissue-specific overexpression of lipoprotein lipase causes tissue-specific insulin resistance.». Proc Natl Acad Sci U S A 98 (13): 7522–7. doi:10.1073/pnas.121164498. PMID 11390966. .
- ↑ (December 2017) «Lipoprotein Lipase Expression in Chronic Lymphocytic Leukemia: New Insights into Leukemic Progression». Molecules 22 (12): 2083. doi:10.3390/molecules22122083. PMID 29206143.
- ↑ (8 December 2015) «Metabolism pathways in chronic lymphocytic leukemia». Leukemia & Lymphoma 57 (4): 758–65. doi:10.3109/10428194.2015.1106533. PMID 26643954.
- ↑ (July 2005) «The LPL/ADAM29 expression ratio is a novel prognosis indicator in chronic lymphocytic leukemia». Blood 106 (2): 650–7. doi:10.1182/blood-2004-08-3344. PMID 15802535.
- ↑ (July 2005) «High expression of lipoprotein lipase in poor risk B-cell chronic lymphocytic leukemia». Leukemia 19 (7): 1216–23. doi:10.1038/sj.leu.2403748. PMID 15858619.
- ↑ (January 2006) «The predictive value of lipoprotein lipase for survival in chronic lymphocytic leukemia». Haematologica 91 (1): 56–63. PMID 16434371.
- ↑ (June 2006) «Lipoprotein lipase expression is a novel prognostic factor in B-cell chronic lymphocytic leukemia». Leukemia & Lymphoma 47 (6): 1053–61. doi:10.1080/10428190500464161. PMID 16840197.
- ↑ (March 2010) «Lipoprotein lipase is differentially expressed in prognostic subsets of chronic lymphocytic leukemia but displays invariably low catalytical activity». Leukemia Research 34 (3): 301–6. doi:10.1016/j.leukres.2009.07.032. PMID 19709746.
- ↑ (August 2011) «LPL is the strongest prognostic factor in a comparative analysis of RNA-based markers in early chronic lymphocytic leukemia». Haematologica 96 (8): 1153–60. doi:10.3324/haematol.2010.039396. PMID 21508119.
- ↑ (June 2013) «Lipoprotein lipase in chronic lymphocytic leukaemia - strong biomarker with lack of functional significance». Leukemia Research 37 (6): 631–6. doi:10.1016/j.leukres.2013.02.008. PMID 23478142.
- ↑ (January 2017) «Lipoprotein Lipase as a Prognostic Marker in Chronic Lymphocytic Leukemia». Pathology & Oncology Research 23 (1): 165–171. doi:10.1007/s12253-016-0132-z. PMID 27757836.
- ↑ (August 2018) «LPL protein in Chronic Lymphocytic Leukaemia have different origins in Mutated and Unmutated patients. Advances for a new prognostic marker in CLL». British Journal of Haematology 182 (4): 521–525. doi:10.1111/bjh.15427. PMID 29953583.
- ↑ (November 2016) «Lipoprotein lipase in chronic lymphocytic leukemia: function and prognostic implications». European Journal of Haematology 97 (5): 409–415. doi:10.1111/ejh.12789. PMID 27504855.
- ↑ (March 1994) «The carboxyl-terminal domain of lipoprotein lipase binds to the low density lipoprotein receptor-related protein/alpha 2-macroglobulin receptor (LRP) and mediates binding of normal very low density lipoproteins to LRP». J. Biol. Chem. 269 (12): 8653–8. doi:10.1016/S0021-9258(17)37017-5. PMID 7510694.
- ↑ (December 1994) «A carboxyl-terminal fragment of lipoprotein lipase binds to the low density lipoprotein receptor-related protein and inhibits lipase-mediated uptake of lipoprotein in cells». J. Biol. Chem. 269 (50): 31747–55. doi:10.1016/S0021-9258(18)31759-9. PMID 7989348.
- ↑ (December 1992) «The low density lipoprotein receptor-related protein/alpha 2-macroglobulin receptor binds and mediates catabolism of bovine milk lipoprotein lipase». J. Biol. Chem. 267 (36): 25764–7. doi:10.1016/S0021-9258(18)35675-8. PMID 1281473.
- ↑ (November 2013) «Placental lipoprotein lipase (LPL) gene expression in a placentotrophic lizard, Pseudemoia entrecasteauxii». Journal of Experimental Zoology Part B: Molecular and Developmental Evolution 320 (7): 465–70. doi:10.1002/jez.b.22526. PMID 23939756.
Литература
- Zechner R. The tissue-specific expression of lipoprotein lipase: implications for energy and lipoprotein metabolism (англ.) // Curr. Opin. Lipidol. : journal. — 1997. — Vol. 8, no. 2. — P. 77—88. — doi:10.1097/00041433-199704000-00005. — PMID 9183545.
- Fisher R.M., Humphries S.E., Talmud P.J. Common variation in the lipoprotein lipase gene: effects on plasma lipids and risk of atherosclerosis (англ.) // Atherosclerosis : journal. — 1998. — Vol. 135, no. 2. — P. 145—159. — doi:10.1016/S0021-9150(97)00199-8. — PMID 9430364.
- Beisiegel U. Lipoprotein metabolism (англ.) // Eur. Heart J. : journal. — 1998. — Vol. 19 Suppl A. — P. A20—3. — doi:10.1093/eurheartj/19.Abstract_Supplement.1. — PMID 9519338.
- Pentikäinen M.O., Oksjoki R., Oörni K., Kovanen P.T. Lipoprotein lipase in the arterial wall: linking LDL to the arterial extracellular matrix and much more (англ.) // Arterioscler. Thromb. Vasc. Biol. : journal. — 2002. — Vol. 22, no. 2. — P. 211—217. — doi:10.1161/hq0102.101551. — PMID 11834518.
- Lichtenstein L., Berbée J.F., van Dijk S.J., van Dijk K.W., Bensadoun A., Kema I.P., Voshol P.J., Müller M., Rensen P.C., Kersten S. Angptl4 upregulates cholesterol synthesis in liver via inhibition of LPL- and HL-dependent hepatic cholesterol uptake (англ.) // Arterioscler. Thromb. Vasc. Biol. : journal. — 2007. — November (vol. 27, no. 11). — P. 2420—2427. — doi:10.1161/ATVBAHA.107.151894. — PMID 17761937.
- Lichtenstein L., Mattijssen F., de Wit N.J., Georgiadi A., Hooiveld G.J., van der Meer R., He Y., Qi L., Köster A., Tamsma J.T., Tan N.S., Müller M., Kersten S. Angptl4 protects against severe proinflammatory effects of saturated fat by inhibiting fatty acid uptake into mesenteric lymph node macrophages (англ.) // Cell Metab. : journal. — 2010. — December (vol. 12, no. 6). — P. 580—592. — doi:10.1016/j.cmet.2010.11.002. — PMID 21109191.
